Kaiserslautern – Den Code von Krebszellen mit Künstlicher Intelligenz knacken: Carl-Zeiss-Stiftung fördert Projekt mit fünf Millionen Euro

RPTU | Rheinland-Pfälzische Technische Universität Kaiserslautern-Landau
Den Code von Krebszellen mit Künstlicher Intelligenz knacken: Carl-Zeiss-Stiftung fördert Projekt mit fünf Millionen Euro
Die Diagnose Glioblastom geht mit einer schlechten Überlebenschance einher. Der Gehirntumor zählt zu den aggressivsten Krebsarten. Medikamente sind wenig erfolgreich, auch weil einzelne Zellen des Tumors Resistenzen dagegen entwickeln. Warum das so ist, ist Gegenstand eines neuen Forschungsprojekts, das die Carl-Zeiss-Stiftung für sechs Jahre mit fünf Millionen Euro fördert. Mit Hilfe von Künstlicher Intelligenz (KI) möchten die Projektbeteiligten diese Mechanismen entschlüsseln, um zu verhindern, dass der Tumor resistent wird und um individuelle Therapien zu ermöglichen. Das Projekt wird an der Rheinland-Pfälzischen Technischen Universität Kaiserslautern-Landau (RPTU) koordiniert.
Glioblastome zeichnen sich dadurch aus, dass ihre Zellen Resistenzen gegen Medikamente entwickeln können. „Diese Plastizität erschwert erheblich die Behandlung und ist für die große Mehrheit der Krebstodesfälle verantwortlich“, sagt Projektkoordinator Professor Dr. Naim Bajcinca, der an der RPTU in Kaiserslautern im Bereich der Regelungstechnik und Dynamik forscht und dabei auch KI-Methoden nutzt. Das Forschungskonsortium um Bajcinca möchte im Rahmen des Projekts „Artificial Intelligence for Treating Cancer Therapy Resistance (AI-Care)“ herausfinden, welche molekularbiologischen Prozesse diesem Mechanismus zugrunde liegen. „Wir wollen verstehen, warum und wie die Zellen dazu in der Lage sind und sich an die Therapien anpassen können“, fährt der Professor fort.
Dazu möchten sie ein KI-Modell erstellen, für das sie viele Daten benötigen. Die Forscherinnen und Forscher werden sich dazu einzelne Zellen anschauen, um zu ergründen, was auf Zellebene in den Tumoren passiert. Möglich macht dies die Einzelzell-Sequenzierung. Bei diesem Verfahren erhält man einen spezifischen Fingerabdruck einer einzelnen Zelle. Diese Analyse misst die RNA-Moleküle, die Kopien der DNA sind und Aufschluss über die sogenannte Genexpression in der betreffenden Zelle geben können. Damit lassen sich Rückschlüsse auf den Zustand der Zelle ziehen, beispielsweise welche Gene gerade aktiv sind und welche nicht oder welche Gene mutiert sind. „Auf diese Weise analysieren wir Tausende von Zellen mit jeweils mehr als 20.000 Genen und detektieren dadurch unterschiedliche Zustände verschiedener Zellen, die durch ihre Genexpression definiert sind“, so Bajcinca weiter. Um diese riesengroßen Dimensionalität der Daten zu durchforsten, Muster zu entdecken und Unterschiede aufzuspüren, kommen KI-Methoden zum Einsatz.
Zu Beginn des Projekts wird das Team um Bajcinca auf bestehende Datensätze aus der Literatur zurückgreifen, um ein erstes KI-Modell zu erstellen. Anschließend werden die Daten aus dem Labor in das Modell integriert. „Dabei verwenden wir sogenannte Glioblastom-Organoide, das sind sehr kleine organähnliche Mikrostrukturen. Sie werden von Kolleginnen und Kollegen aus dem Bereich der Biologie untersucht“, erläutert der Kaiserslauterer Professor. In nächsten Schritten wird es darum gehen, das KI-Modell zu verbessern und zu validieren. Da das Aufbereiten der Zelldaten sehr kostenintensiv ist, werden die Projektbeteiligten auch synthetische Daten mittels KI generieren, mit denen das Modell ebenfalls hinzulernen kann.
„Krebs ist ein hochkomplexes dynamisches System. Deshalb müssen wir multidisziplinäres Wissen aus der Zellbiologie, Mathematik und KI kombinieren, um Erkenntnisse zu gewinnen. Mit diesem umfassenden Ansatz hoffen wir, den Code der Plastizität zu entschlüsseln und zu verstehen, was auf der Ebene der Krebszelle wirklich geschieht“, sagt er weiter. „Krebstherapien verändern die Landschaft der Tumorzellen. Es entstehen neue Zellzustände und Übergangswege, die zum Therapieversagen führen. Unser Ziel ist es, ein Modell zu entwickeln, das diese gebildeten Landschaften von Tumorzellen vorhersagen kann. Dies wird nur mit Hilfe von KI möglich sein und markiert einen bahnbrechenden Fortschritt in den Gesundheitswissenschaften.“
Zudem soll das KI-Modell helfen, optimale Medikamenten-Kombinationen vorherzusagen. „Damit könnte man bei jedem Patienten individuell eine Therapie planen, die bestmöglich auf den Tumorzustand abgestimmt ist“, sagt der Professor. Dies müsste aber erst in klinischen Studien überprüft werden. Das Verfahren ließe sich außerdem auf andere tödliche Krebsarten übertragen. „Auch hier lassen sich solche Resistenzen beobachten. Unser Modell ließe sich mit entsprechenden Daten anpassen“, ergänzt Bajcinca.
Professor Bajcinca und Dr. Sandesh Hiremath koordinieren das Projekt. An der RPTU beteiligt sind außerdem Arbeitsgruppen aus Biologie (Professorin Dr. Tanja Maritzen, Professorin Dr. Zuzana Storchová), Informatik (Juniorprofessorin Dr. Sophie Fellenz, Professor Dr. Marius Kloft) sowie Mathematik (Professorin Dr. Anna Hundertmark, Professor Dr. Nicolas R. Gauger). Darüber hinaus arbeiten Bioinformatik-Professor Dr. Carl Hermann von der Universität Heidelberg sowie die beiden Biowissenschaftler Dr. Hai-Kun Liu und Dr. Bernhard Radlwimmer vom Deutschen Krebsforschungszentrum Heidelberg am Projekt mit. Gefördert wird es von der Carl-Zeiss-Stiftung im Rahmen des Förderprogramms „CZS Durchbrüche“, das 2023 zu „KI in der Gesundheit“ ausgeschrieben wurde.
Die Vorarbeiten zu diesem Projekt fanden an der RPTU unter anderem im Profilbereich „BioComp – Complex Data Analysis in Life Sciences and Biotechnology“ statt – ein Teil der Forschungsinitiative Rheinland-Pfalz.
Aktuelle Beiträge
2. April 2025
Events
GIRLSWALK – Gemeinsam unterwegs neue Freundschaften knüpfen
5. April 2025 - 10:00 Uhr bis 11:00 Uhr
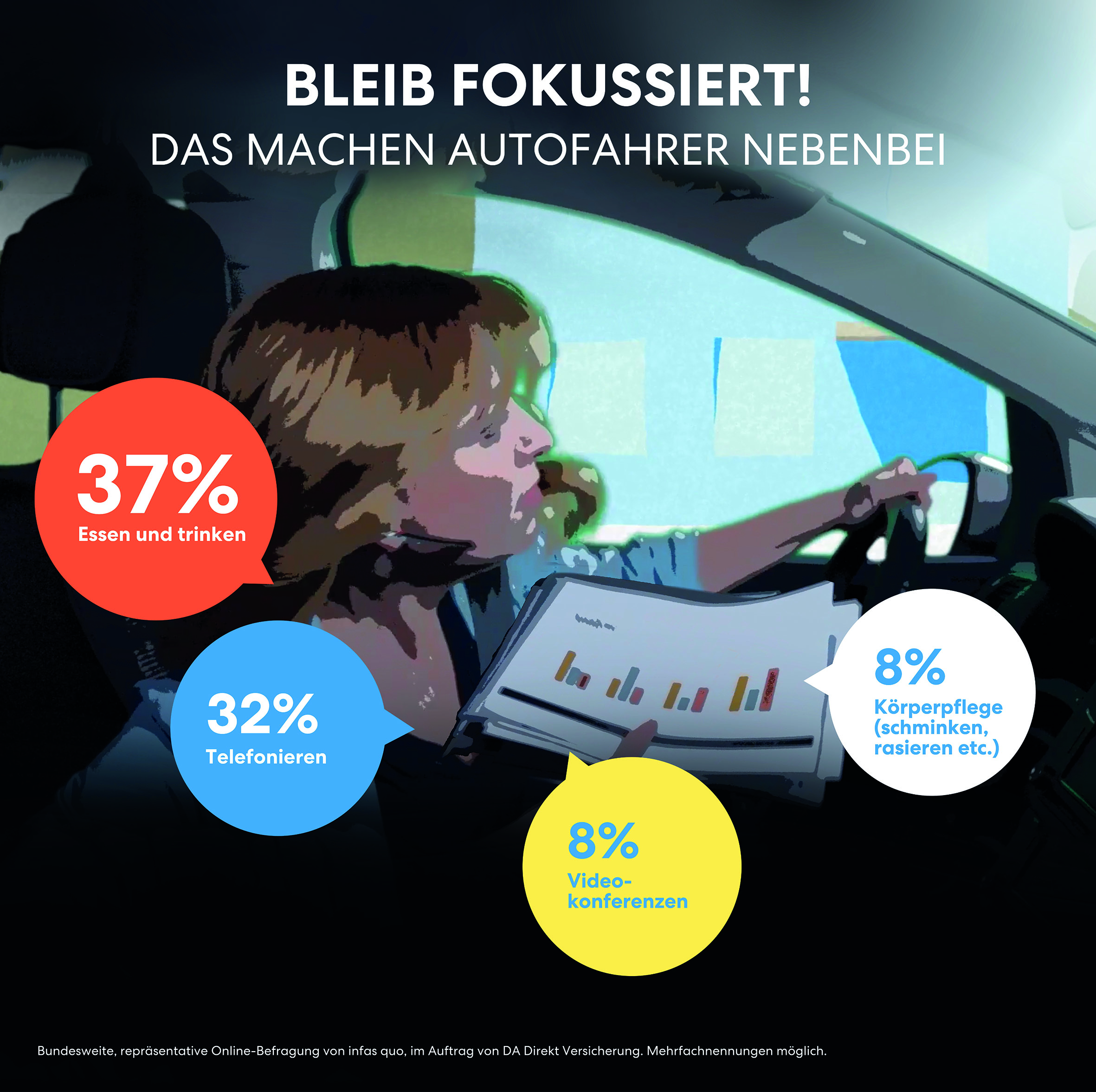
BUNT GEMISCHT
26. März 2025
20. März 2023
18. September 2023
6. April 2023
16. Januar 2024
28. Juli 2023
16. August 2023
28. Juni 2021
12. April 2023
2. März 2025
4. März 2024
1. Januar 2025
6. April 2021
21. Juli 2023
31. März 2025
3. August 2023
11. Dezember 2024
7. August 2023
20. November 2023
6. April 2021
16. Dezember 2022
17. Juli 2023
23. Januar 2025
16. Januar 2025
20. November 2024
5. Januar 2025
19. April 2021
7. Juni 2024
27. März 2023
14. Juli 2023
5. April 2023
5. April 2023
21. Mai 2024
2. August 2023
3. Mai 2024
5. Juli 2023
7. August 2023
6. Februar 2021